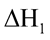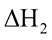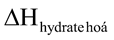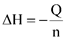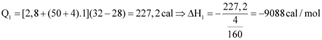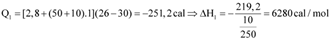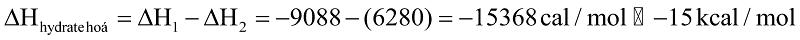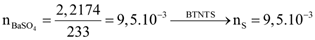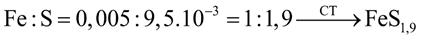Câu 5. Nhiệt hydrate hoá là lượng nhiệt kèm theo quá trình tạo thành 1 mol muối ngậm nước từ muối khan và lượng nước tương ứng. Ví dụ, sự tạo thành dung dịch CuSO4 trong n mol H2O:
Quá trình hòa tan CuSO4 khan: CuSO4 (s) + nH2O CuSO4(aq)
CuSO4(aq) 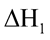
Quá trình hòa tan CuSO4.5H2O khan: CuSO4.5H2O + (n-5)H2O CuSO4 (aq)
CuSO4 (aq) 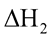
Quá trình hydrate hóa: CuSO4 (s) + 5H2O CuSO4.5H2O (s)
CuSO4.5H2O (s) 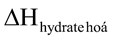
Theo định luật Hess ta có: 
Xác định bằng thực nghiệm nhiệt hoà tan của muối khan và muối ngậm nước sẽ tính được nhiệt hydrate hoá.
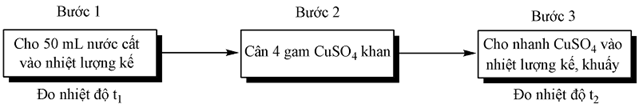
Thực hiện thực nghiệm để xác định nhiệt hydrate hóa của CuSO4 với các thông tin như sau:
Thí nghiệm 1: Xác định nhiệt hòa CuSO4 khan.
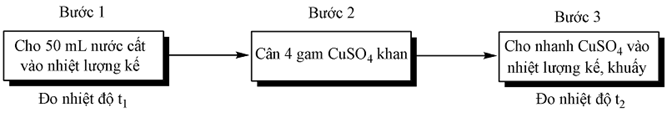
Thí nghiệm 2. Xác định nhiệt hòa CuSO4.5H2O khan : thực hiện tương tự sơ đồ trên chỉ thay bằng 10 gam CuSO4.5H2O.
Bảng số liệu thực nghiệm đo được như sau:
|
Thí nghiệm 1 |
Thí nghiệm 2 |
|
|
Nhiệt độ t1 |
28 |
30 |
|
Nhiệt độ t2 |
32 |
26 |
|
Nhiệt lượng của nhiệt lượng kế (m0c0) |
2,8 cal/độ |
|
Công thức tính nhiệt lượng : Q = (m0c0 + m.c).(t2-t1)
Với m0c0 là nhiệt của nhiệt lượng kế
m là khối lượng trong bình nhiệt lượng kế (gồm khối lượng chất + khối lượng nước)
c là 1 cal/độ.
Hãy tính enthalpy hydrate hóa của CuSO4 bằng đơn vị kcal/mol. (cho biết 1 cal=4,184 J và 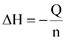 với n là số mol chất).
với n là số mol chất).
Câu 6. Theo lý thuyết công thức của quặng pyrite là FeS2. Thực tế một phân ion disulfide S2- bị thay thế bởi ion sulfide (S2-) nên coi pyrite như một hỗn hợp của FeS2 và FeS. Như vậy, công thức tổng quát của pyrite có thể biểu diễn là FeSx). Khi xử lí m gam một mẫu pyrite (chỉ gồm FeS2 và FeS) bằng bromine trong dung dịch KOH dư người ta thu được kết tủa nâu đỏ A và dung dịch B. Nung kết tủa A đến khối lượng không đổi thu được 0,4 gam chất rắn. Thêm lượng dư dung dịch BaCl2 vào dung dịch B thì thu được 2,2174 gam kết tủa trắng không tan trong acid. Xác định giá trị x trong công thức tổng quát FeSx của quặng pyrite.
Đề thi thử TN THPT 2025 - Cấu trúc mới - Môn Hóa Học - Đề 36 - File word có lời giải