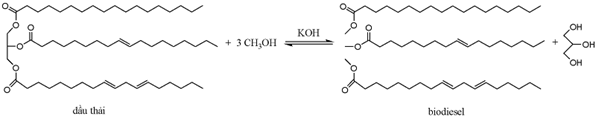
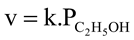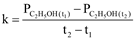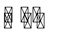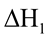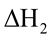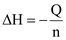|
ĐỀ THI THỬ CHUẨN CẤU TRÚC MINH HỌA ĐỀ 36 (Đề thi có 04 trang) |
KỲ THI TỐT NGHIỆP THPT NĂM 2025 MÔN: HÓA HỌC Thời gian làm bài 50 phút; không kể thời gian phát đề |
- Tải file word kèm ma trận và lời giải chi tiết ( 20k/Đề ) - LH Zalo 0915347068
Họ, tên thí sinh: .....................................................................
Số báo danh: ..........................................................................
Cho biết nguyên tử khối: H = 1, C = 12, N = 14, O = 16, Na = 23, Mg = 24, Al = 27, S = 32, K = 39,
Ca = 40, Fe = 56, Cu = 64, Zn = 65, Ag = 108.
PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18 . Mỗi câu hỏi thí sinh chỉ chọn một phương án.
A. Liên kết ion. B. Liên kết hydrogen. C. Liên kết kim loại. D. Liên kết cho- nhận
Câu 2. Nguyên tắc làm mềm nước cứng là làm giảm nồng độ của các ion nào sau đây?
A. Ion sulfate và ion chloride. B. Ion nitrate và ion hydrogencarbonate.
C. Ion magnesium và ion calcium. D. Ion sodium và ion potassium.
Câu 3. Cho công thức cấu tạo của tetrathionic acid (H2S4O6) như sau:
Số oxi hóa của nguyên tử sulfur được đánh dấu (*) trong tetrathionic acid là
A. Cu và Fe. B. Fe và Cu. C. Cu và Ag. D. Fe và Ag.
A. đỏ tía. B. đỏ cam. C. tím nhạt. D. vàng.
Câu 6. Các nguyên tố nào sau đây thường được dùng để chế tạo nam châm điện?
A. Cobalt và chromium. B. Sắt và cobalt.
C. Nickel và manganese. D. Sắt và chromium.
Câu 7. Trong dung dịch thuốc thử Tollens, phức Ag[(NH3)2]OH phân li như sau:
Ag[(NH3)2]OH  Ag[(NH3)2]+ + OH-
Ag[(NH3)2]+ + OH-
A. Ag+. B. NH3+. C. NH3. D. Ag.
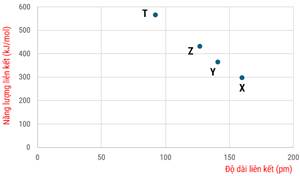
Các chất X, Y, Z, T lần lượt là
A. HF, HCl, HBr, HI B. HI, HBr, HCl, HF C. HCl, HF, HBr, HI D. HI, HBr, HF, HCl
A. Ala-Gly-Val. B. Gly-Ala-Val. C. Val-Gly-Ala. D. Val-Ala-Gly.
Câu 10. Cellulose không có tính chất nào sau đây?
A. Bị thủy phân trong dung dịch acid hoặc enzyme.
B. Phản ứng với nitric acid đặc (xúc tác sulfuric acid đặc)
D. Phản ứng với thuốc thử Tollens.
Câu 11. Cho các phát biểu sau:
(a) Cao su thiên nhiên chứa các mắt xích isoprene, liên kết đôi trong mạch đều ở dạng cis.
(b) Thủy phân không hoàn toàn tripeptide Ala-Gly-Ala thu được tối đa 2 dipeptide.
(c) Keo dán epoxy có thành phần chính là chất hữu cơ có nhóm –COOH và -NH2 ở hai đầu.
(d) Tách tinh dầu từ hỗn hợp tinh dầu và nước bằng dung môi hexane là phương pháp chiết lỏng - lỏng.
A. không no, đa chức. B. không no, đơn chức.
C. no, đơn chức. D. no, đa chức.
A. Nylon-6,6 là sản phẩm của phản ứng trùng ngưng từ các monomer đa chức.
B. Nylon-6,6 không có liên kết hydrogen nên kém bền với nhiệt.
C. Nylon-6,6 là polymer tổng hợp có chứa liên kết peptide.
D. Nylon-6,6 có thể tan trong nước nóng và phân hủy dễ dàng.
(a) Trong bốn chất thì X có khả năng tạo liên kết hydrogen liên phân tử với nước mạnh nhất.
(b) Chất Y có nhiệt độ sôi cao nhất trong 4 chất.
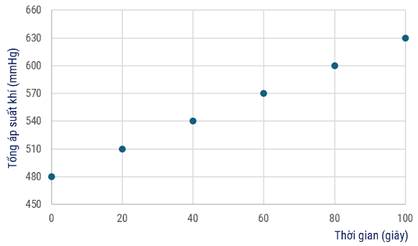
Ví dụ cho phương trình: a A + b B  c C
c C
Thương số phản ứng 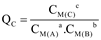 với giá trị nồng độ là nồng độ ban đầu của các chất.
với giá trị nồng độ là nồng độ ban đầu của các chất.
∙ QC < KC: phản ứng chưa cân bằng, chuyển dịch theo chiều thuận
∙ QC > KC: phản ứng chưa cân bằng, chuyển dịch theo chiều nghịch
Biểu thức Q được tính theo nồng độ các chất ở điều kiện bất kì như sau:
Cho cân bằng sau: N2 + 3H2  2NH3 KC = 64
2NH3 KC = 64
A. Hệ đạt trạng cân bằng và áp suất hệ không thay đổi.
B. Hệ đạt trạng cân bằng và đang chuyển dịch theo chiều thuận làm giảm áp suất của hệ.
C. Hệ chưa đạt trạng thái cân bằng và chuyển dịch theo chiều thuận làm tăng áp suất của hệ.
D. Hệ chưa đạt trạng thái cân bằng và chuyển dịch theo chiều thuận làm giảm áp suất của hệ.
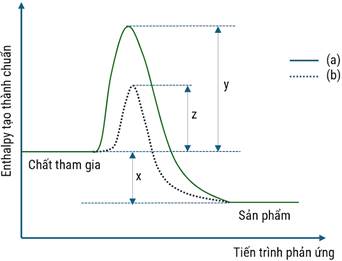
Phát biểu nào sau đây là đúng ?
A. Giản đồ (a) là của phản ứng khi có dùng xúc tác.
B. Phản ứng trên là phản ứng thu nhiệt.
C. Năng lượng hoạt hóa của phản ứng khi không dùng xúc tác có giá trị là y và y > 0.
D. Chất xúc tác có vai trò là làm tăng năng lượng hoạt hóa của phản ứng.
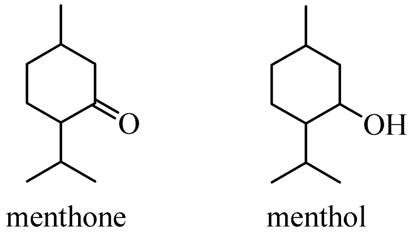
Câu 17. Năm 2024, trong chương trình “Đường lên đỉnh Olympia” đã đưa ra một câu hỏi về hai
chất menthone và menthol (có trong tinh dầu bạc hà) có công thức cấu tạo cho dưới đây:
Phát biểu nào sau đây là đúng?
A. Phổ hồng ngoại (IR) của menthol có vùng hấp thụ khoảng 1700 ± 50 cm–1.
B. Có thể oxi hóa methone bằng NaBH4 hoặc LiAlH4 thu được menthol.
C. Phân tử menthone và menthol khác nhau 2 nguyên tử hydrogen.
D. Menthol thuộc loại hợp chất phenol.
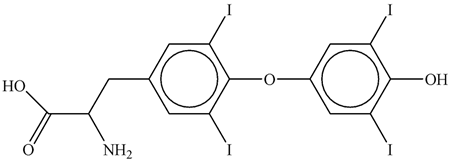
Cho các phát biểu sau về tirozin:
(a) Bổ sung muối iodine là bổ sung muối ăn trộn I2.
(b) Số nguyên tử carbon của Tirozksin là 15.
(c) Tirozksin là hợp chất hữu cơ tạp chức.
(d) Độ bất bão hòa của Tirozksin là 7.
(e) Ở điều kiện thường, Tirozksin có thể tác dụng với NaOH và HCl.
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
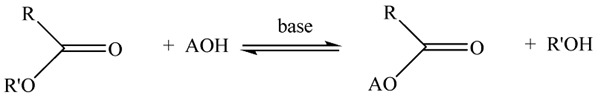
Câu 1. Cho phản ứng tách nước của ethanol (có xúc tác Al2O3 ở nhiệt độ cao > 500 K) như sau: