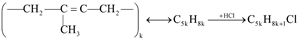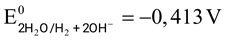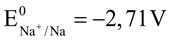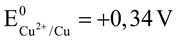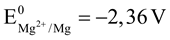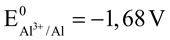|
ĐỀ THI THỬ CHUẨN CẤU TRÚC MINH HỌA ĐỀ 33 (Đề thi có 04 trang) |
KỲ THI TỐT NGHIỆP THPT NĂM 2025 MÔN: HÓA HỌC Thời gian làm bài 50 phút; không kể thời gian phát đề |
- Tải file word kèm ma trận và lời giải chi tiết ( 20k/Đề ) - LH Zalo 0915347068
-Bộ 50 đề chuẩn cấu trúc minh họa 100% file word kèm ma trận và lời giải chi tiết ( 100k/50Đề ) - LH Zalo 0915347068
Họ, tên thí sinh: .....................................................................
Số báo danh: ..........................................................................
Cho biết nguyên tử khối: H = 1, C = 12, N = 14, O = 16, Na = 23, Mg = 24, Al = 27, S = 32, K = 39,
Ca = 40, Fe = 56, Cu = 64, Zn = 65, Ag = 108.
PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18 . Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1. Chất nào sau đây không tan trong nước lạnh nhưng tan một phần trong nước nóng ?
A. glucose. B. tinh bột. C. fructose. D. saccharose.
Câu 2. Dung dịch nào sau đây phản ứng với dung dịch NH3 dư thu được kết tủa?
A. CuCl2. B. NaCl. C. AgNO3. D. Al(NO3)3.
Câu 3. Chất nào sau đây có thể tham gia phản ứng trùng ngưng?
A. acrylic acid. B. vinyl cyanide. C. ethylene glycol. D. buta-1,3-diene.
Câu 4. Cho các phát biểu sau khi nói về tính chất của ethylamine C2H5NH2:
(1) Ethylamine có khả năng tạo được liên kết hydrogen liên phân tử
(2) Khi hòa tan vào trong nước, dung dịch ethylamine làm giấy quỳ tím hóa xanh
(3) Khi cho ethylamine phản ứng với NaNO2/(HCI) ở nhiệt độ thường thu được sản phẩm chứa ethanol
(4) Phản ứng của AlCl3 với dung dịch ethylamine cho phức chất màu xanh tím
Câu 5.. Công thức phức chất aqua của ion Mn2+ và ion Co3+ có dạng hình học bát diện là
A. [Mn(H2O)6]2+ và [Co(H2O)6]3+. B. [Mn(H2O)6]4+ và [Co(H2O)6]6+.
C. [Mn(H2O)]²+ và [Co(H2O)6]3+. D. [Mn(H2O)6]2+ và [Co(H2O)]3+.
Câu 6. Cho các cân bằng hóa học sau:
(1) N2(g) + 3H2(g) 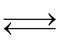 2NH3(g)
2NH3(g) 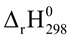 < 0
< 0
(3) C(s) + H2O(g) 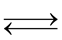 CO(g) + H2(g)
CO(g) + H2(g) 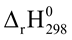 > 0
> 0
(4) CaCO3(s) 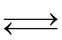 CaO (s) + CO2(g)
CaO (s) + CO2(g) 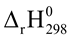 > 0
> 0
C. Khi tăng nhiệt độ của 4 cân bằng trên thì có 4 cân bằng tốc độ phản ứng tăng lên.
A. vinyl acetate. B. vinyl formate. C. methyl acrylate. D. allyl formate.
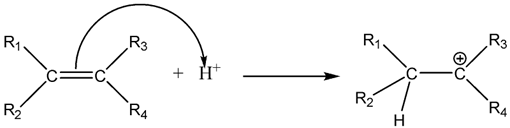
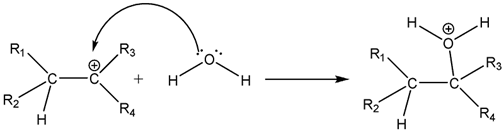
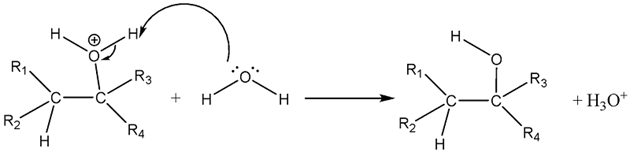
Câu 10. Alanine phản ứng với ethyl alcohol khi có mặt HCI khan theo sơ đồ sau:
Phát biểu nào sau đây là đúng?
B. Sản phẩm X thu được có công thức là H2NCH(CH3)COOC2H5.
C. Phần trăm khối lượng của nitrogen trong X là 8,16%.
D. 1 mol X tác dụng tối đa được với 2 mol NaOH, thu được Ala.
Câu 11. Tiến hành thí nghiệm theo các bước sau:
Bước 1: Lấy vào ống nghiệm (1) 0,5 mL dung dịch HNO3 đặc (68%)
ống nghiệm (2) 0,5 mL dung dịch HCl đặc.
(a) Ở ống nghiệm (1), mảnh đồng tan dần, dung dịch chuyển sang màu xanh.
(b) Ở ống nghiệm thứ hai, thấy có khí không màu, không hóa nâu thoát ra khỏi dung dịch.
(c) Bông tẩm dung dịch NaOH có tác dụng hạn chế khí độc thoát ra khỏi ống nghiệm.
(d) Có thể thay bông tẩm dung dịch NaOH bằng bông tẩm dung dịch NaCl.
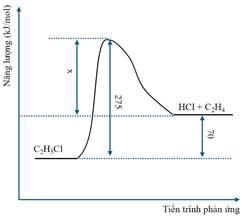
- X có đồng phân hình học và dung dịch X làm đổi màu quỳ tím.
Phát biểu nào sau đây là đúng?
B. T có đồng phân hình học và có thể tác dụng bromine theo tỷ lệ 1 : 1.
C. Z được điều chế trực tiếp từ acid và alcohol tương ứng.
(2) Độ ẩm giúp tạo một lớp điện li mỏng, cho phép các ion di chuyển tự do, hỗ trợ quá trình ăn mòn.
Câu 15. Protein có trong lòng trắng trứng là
A. Keratin. B. Fibroin. C. Albumine. D. Hemoglobin.
Câu 16. Trong nước nguyên chất khi phản ứng xảy ra sẽ có quá trình sau:
Phát biểu nào sau đây là đúng?
B. Tính khử của các kim loại tăng dần theo thứ tự sau: Na< Mg < Al < Cu
C. Kim loại Mg, Al tác dụng được với nước nhưng phản ứng xảy ra chậm.
D. Khi cho mẩu Na vào dung dịch CuSO4 thu được thì Na sẽ chạy trên mặt nước, có khói trắng và có kết tủa nâu xuất hiện.
A. KCl. B. KOH. C. NaCl D. K2CO3.
Bước 1: Cho NaCl vào nước ở 90oC đến bão hòa.
Bước 2: Cho quặng Sylvinite vào dung dịch đó đến bão hòa KCl và tách lấy NaCl không tan.
Bước 3: Đưa nhiệt độ dung dịch bão hòa ở trên về 10oC và tách lấy KCl kết tinh.